Les catalyseurs minéraux trouvés dans les cheminées des grands fonds marins convertissent le CO2 et l’H2 en biomolécules, montrant des parallèles frappantes avec les voies biologiques connues
Une collaboration internationale de chercheurs en Allemagne, en France et au Japon a étudié les activités catalytiques des minéraux trouvés dans les cheminées hydrothermales des grands fonds marins. Les résultats suggèrent que les réactions chimiques induites par les minéraux pourraient être étroitement liées au métabolisme microbien du carbone.
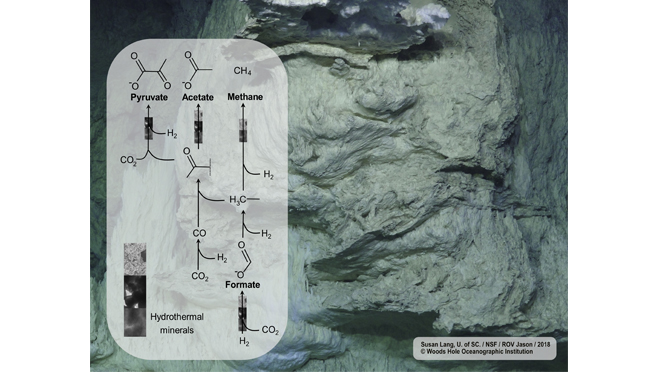
La vie sur Terre n’aurait pas pu commencer sans le métabolisme. Les cheminées hydrothermales alcalines ont été proposées comme un environnement possible où une forme primitive de métabolisme (protométabolisme) antérieure à la vie cellulaire pourrait avoir émergé. Les premières étapes du métabolisme, qui auraient commencé par la chimie géologique, pourraient encore être conservées dans les voies biochimiques que les biologistes évolutionnistes ont identifiées comme étant anciennes. L’une d’entre elles est la voie de l’acétyl-CoA. Les micro-organismes l’utilisent pour convertir le dioxyde de carbone (CO2) en acétate et en pyruvate, servant de point d’entrée à un métabolisme du carbone plus complexe. Il est intéressant de noter que c’est la seule voie connue de fixation du carbone biologique qui utilise l’hydrogène (H2) comme source d’électrons, et que l’H2 est très abondant dans les cheminées hydrothermales alcalines. Cependant, la fixation du CO2 pour obtenir des biomolécules dans des conditions biologiques pertinentes pour les systèmes hydrothermaux n’est pas évidente.
En cherchant un pont entre l’abiotique (non vie) et le biotique (vie), les chercheurs allemands, français et japonais se sont inspirés des caractéristiques de la voie biologique de l’acétyl-CoA. En biologie, des enzymes complexes facilitent la réaction entre le CO2 et l’H2, mais les minéraux hydrothermaux peuvent servir de catalyseurs pour la version non enzymatique de cette même réaction. Le professeur Joseph Moran, un chimiste organique qui s’intéresse à l’origine protométabolique de la vie et qui dirige le Laboratoire de catalyse chimique de l’Université de Strasbourg (France), explique : “Ce que les enzymes de la voie de l’acétyl-CoA et les minéraux hydrothermaux ont en commun, ce sont les métaux de transition comme le fer (Fe) et le nickel (Ni). Ces métaux sont également couramment utilisés comme catalyseurs en chimie organique pour favoriser des réactions notoirement difficiles”. L’équipe basée à Strasbourg avait déjà exploré la possibilité de fixer le CO2 seul en utilisant du fer métallique dans le contexte de l’origine de la vie. C’était le bon moment pour passer aux catalyseurs minéraux géologiquement abondants.
Le professeur William Martin, biologiste à l’université Heinrich Heine de Düsseldorf, étudie depuis deux décennies les parallèles entre la fixation biochimique et géochimique du CO2. “Dans des conditions physiologiques, l’H2 seul n’est pas suffisamment réducteur pour fixer le CO2. Nous voulions trouver des catalyseurs qui auraient pu soutenir la vie au tout début, avant que les mécanismes biologiques complexes ne soient en place”, dit Martin. Avec la chimiste Martina Preiner (co-premier auteur de l’article), ils ont contacté un groupe de recherche de l’Institut Max Planck pour la recherche sur le charbon à Mülheim, en Allemagne, dirigé par le Dr Harun Tüysüz, qui est spécialisé dans la catalyse hétérogène. Après un certain remue-méninge, Martin, Moran et Tüysüz ont décidé que les expériences commenceraient avec de l’H2, du CO2 et des minéraux trouvés dans les cheminées hydrothermales alcalines : l’awaruite et la magnétite. Cependant, les trois équipes n’étaient pas les seules à avoir un objectif similaire. Des chercheurs de Tokyo et de Sapporo (Institut de recherche sur la bioproduction, Institut national des sciences et technologies industrielles avancées) avaient commencé à réduire le CO2 avec de l’H2 en utilisant des catalyseurs à base de sulfure de fer (par exemple, le minéral greigite), qui sont également courants dans les cheminées hydrothermales. Le Dr Kensuke Igarashi, microbiologiste (co-premier auteur de l’étude), qui a réalisé des expériences avec la greigite à Sapporo, explique : “Il était clair que nous pouvons parvenir à une compréhension plus approfondie de nos résultats si nous les partageons entre nous”.
En effet, cette approche ouverte s’est avérée très fructueuse. Bien que la fixation du CO2 avec l’H2 sur trois minéraux hydrothermaux – l’awaruite (Ni3Fe), la magnétite (Fe3O4) et la greigite (Fe3S4) – ait été réalisée dans trois laboratoires différents dans le monde entier, les résultats aboutissent à la même conclusion. “Tous ces minéraux catalysent la fixation du CO2 avec l’H2 dans l’eau et donnent des produits qui correspondent à ceux de la voie biologique de l’acétyl-CoA : formiate, acétate et pyruvate”, explique la Dr Kamila Muchowska, chimiste strasbourgeoise et co-première auteure de l’article, responsable des expériences sur la magnétite. “Nous avons étudié la surface de tous les minéraux testés et nous avons des preuves solides que les réactions sont catalytiques et se produisent à la surface du minéral”, explique Tüysüz. “Dans le processus hydrothermal de la fixation du CO2, l’hydrogène agit comme un donneur d’électrons et d’énergie, tout comme en biologie. C’est vraiment étonnant”, ajoute M. Preiner.
Les résultats des chercheurs suggèrent que de simples réactions géochimiques abiotiques auraient pu ouvrir la voie à un métabolisme précoce que les microbes utilisent encore aujourd’hui. Les minéraux hydrothermaux auraient pu servir d’amorces géochimiques pour l’émergence ultérieure de la voie enzymatique de l’acétyl-CoA.
Citation:
Preiner, M., Igarashi, K., Muchowska, K.B. et al. A hydrogen-dependent
geochemical analogue of primordial carbon and energy metabolism. Nat Ecol
Evol 4, 534–542 (2020). https://doi.org/10.1038/s41559-020-1125-6